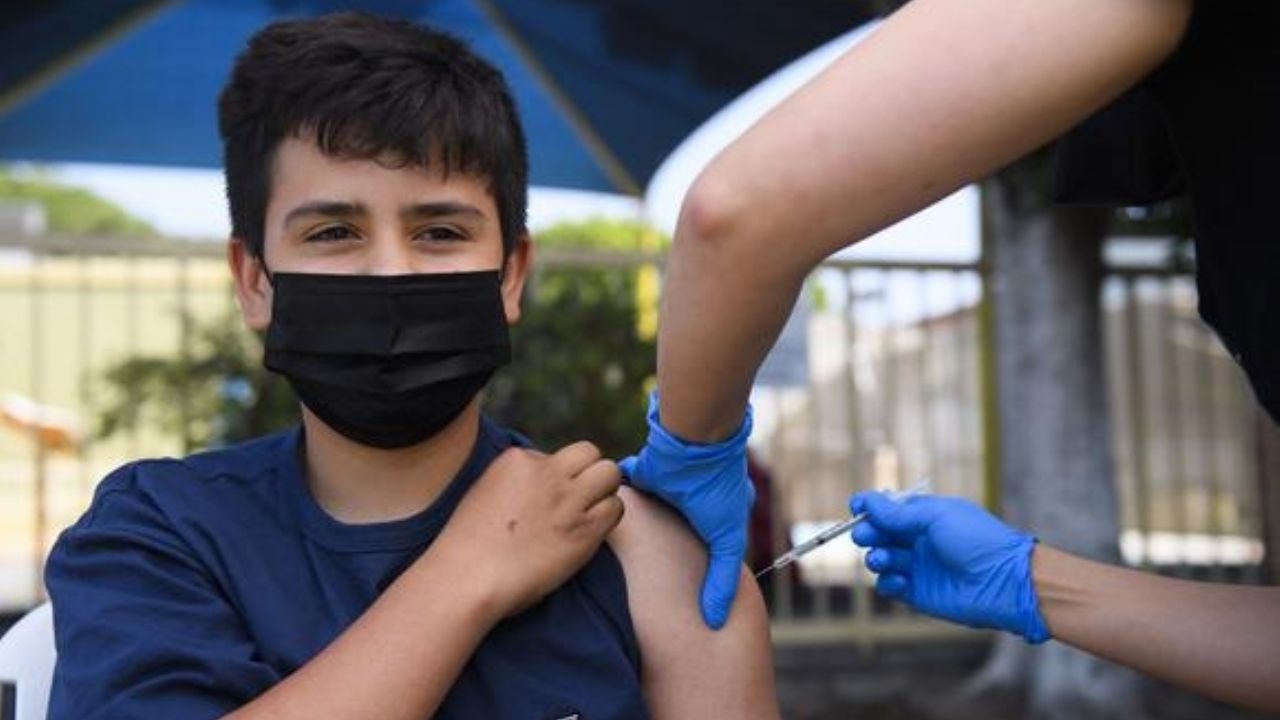
Salud.- La farmacéutica Pfizer-BioNTech, compartió que ya se enviaron para una revisión inicial, los datos de la vacuna contra COVID-19 para niños de 5 a 11 años a la Administración de Alimentos y Medicamentos de Estados Unidos.
Da click aquí y encuentra más información de Línea Directa Portal en nuestra página de Google News
Según el comunicado compartido, se espera que se realice una presentación formal para solicitar la autorización de uso de emergencia en Estados Unidos para la vacuna en las próximas semanas.
También se planean presentaciones a la Agencia Europea de Medicamentos y otras autoridades reguladoras, dijeron en un comunicado de prensa.
Pfizer-BioNTech se convierte en la primera farmacéutica en enviar a la FDA los datos para una vacuna contra COVID-19 para niños pequeños. La vacuna está aprobada para personas mayores de 16 años y en la Unión Europea a personas de 12 a 15 años.
Pfizer publicó la semana pasada detalles de un ensayo de fase 2/3 que mostró que su vacuna era segura y generó una respuesta de anticuerpos “robusta” en niños de 5 a 11 años.
En el ensayo participaron 2268 niños de 5 a 11 años y en las pruebas utilizó un régimen de dos dosis de la vacuna administrado con 21 días de diferencia. Este ensayo utilizó una dosis de 10 microgramos, menor que la dosis de 30 microgramos que se ha utilizado para los mayores de 12 años.
La Administración de Alimentos y Medicamentos de Estados Unidos señaló que una vez que se envíen los datos de la vacuna, la agencia podría autorizarla en cuestión de semanas, no meses, pero dependería del momento y la calidad de los datos proporcionados.
Se espera que la FDA convoque a sus asesores de vacunas para hacer una recomendación sobre la vacuna antes de la autorización. Si la FDA lo aprueba, un panel de asesores de vacunas de los CDC se reunirá para considerar si recomendar su uso.
Te sugerimos: ¡Impresionante! NASA revela erupción del volcán de La Palma vista desde el espacio